Introduction
生命総体としての人間を対象に,情報科学,ならびに工学技術を応用した研究・教育を行っています. 特に,近年いっそうの高度化とQOL (quality of life) の重視が要求されている医療への直接的な貢献を目指し,診断・治療技術の開発・高度化と,その発展を支える人材の育成を行っています.
Photonics グループでは,光を用いた診断技術の開発を行なっています.超短パルスレーザーを駆使した非線形ラマン散乱イメージングのほか,生体光透視,光断層撮影,蛍光イメージング法などの開発を行なっています.
Ultrasound グループでは,超音波を用いた診断技術とマイクロバブルを用いた細胞レベルでの治療技術の開発などを行なっています.
医用生体工学,光学,分光学,電子・情報・通信工学などを背景とするスタッフが協力して学際的な研究・教育を推進しています.
Photonics Group
- 分子の振動で組織・病変部を可視化する
- 同期超短パルスレーザーの開発
- 光透視
- 光断層撮影
- 蛍光イメージング
病理診断では,患者の体より採取された病変の組織や細胞からガラス標本を作ってこれを観察し,診断を行ないます.しかし,組織や細胞はほとんど無色なため,そのままでは観測ことができず “染色”により色を付けて観測を行います.染色は生きた細胞に影響を与えるため,ヒトに適用することは容易ではありません.また,往々にして時間を要します.したがって,無染色に組織や病変部を見分けることができれば,より安全で素早く診断・治療を行なうことが可能となります.
分子は,原子(質点)が化学結合(ばね)によってつながれているため,振動することができ,その分子の振動の周波数は,分子の種類や構造に敏感です.この分子の振動を用いて細胞・組織を見分けて可視化するイメージング装置の開発や診断への応用を行なっています.
従来用いられてきた,自発ラマン散乱は非常に微弱なため,計測に時間を要していました.非線形ラマン散乱を利用することで,無染色に組織や病変部を見分け,かつ高速な観測法の開発を行なっています.

動画を再生するにはvideoタグをサポートしたブラウザが必要です.
ビデオレートを越える 100 frame/s で観測した脂肪様細胞の非線形ラマンイメージング(左).非線形ラマン散乱を利用した内視鏡(硬性鏡)(右)
 非線形ラマン散乱イメージングには特殊な光源が必要です.波長幅が狭くかつ瞬間的(ピコ秒)に光り,波長が異なる2つのレーザーパルスを同時に試料に照射する必要があります.また,一方のレーザー光源の波長を高速に変化させる必要もあります.このようなレーザー光源も独自に開発することで,医療現場で使える無染色イメージングを実現しようとしています.
非線形ラマン散乱イメージングには特殊な光源が必要です.波長幅が狭くかつ瞬間的(ピコ秒)に光り,波長が異なる2つのレーザーパルスを同時に試料に照射する必要があります.また,一方のレーザー光源の波長を高速に変化させる必要もあります.このようなレーザー光源も独自に開発することで,医療現場で使える無染色イメージングを実現しようとしています.
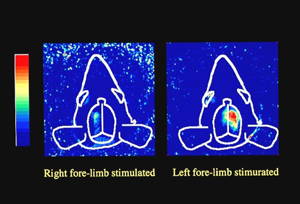
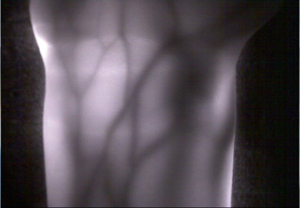
光による生体計測は,体内臓器の形態だけではなく,生体機能の計測を可能とすることから新しい診断技術として期待されています.そのなかで光透視は非常に簡便な装置で実現可能であり,実験動物の脳や臓器の機能的変化の透視イメージング,また血管が見えにくい人への静脈注射などの治療支援,さらには今後の情報セキュリティ強化のための静脈認証を目的として血管透視についての研究を進めています.
|
ラット脳機能透視イメージング |
成人前腕部血管透視イメージング |

X線等の断層撮影技術は現在まで広く普及していますが,放射線被曝や装置の規模の面で課題があります.生体にとって安全性が高く,コンパクトな機器で構成可能な光技術による断層撮影技術の開発を進めています.
光断層撮影技術
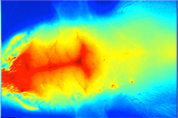
がんに選択的に集まる蛍光薬剤や血管造影用の蛍光薬剤が開発されています.そこで,生体機能情報の蛍光イメージングを進めています.さらに,生体の深部にある蛍光のボケについて,画像処理による復元処理法の開発を行っています.
ラット脳血管蛍光造影技術
Ultrasound Group
- 微小気泡を用いた診断と治療
- 微小気泡の運動の超高速撮影
- 微小気泡が細胞に与える作用の解明
- 光ピンセットによる気泡の位置制御
- 微小気泡の開発
- 生体内での治療に向けたソノポレーション現象の解明
- 期外収縮の発生メカニズムの検討
- 見えない超音波を可視化する
ナノサイズ(10000分の1ミリ),ミクロンサイズ(1000分の1ミリ)の微小気泡を血管内に注射し,超音波を照射することにより,これまで見えなかった微小な病変を検出することが可能になります.また,微小気泡を薬物や遺伝子を運ぶ入れ物として利用することにより,体内深部にある病変を治療することが可能になります.この技術は,安全な局所治療を実現する手法として注目されています.私たちは,この技術の実用化を目指して,様々な方面から研究を行っています.
 超音波の照射を受けると気泡は膨張収縮し,受けたエネルギーを一点に集中する働きをすると考えられています.我々は,1秒間に最大2000万コマの速度で気泡の振動を観察し,そのメカニズムを検討しています.
超音波の照射を受けると気泡は膨張収縮し,受けたエネルギーを一点に集中する働きをすると考えられています.我々は,1秒間に最大2000万コマの速度で気泡の振動を観察し,そのメカニズムを検討しています.
毎秒1600万コマの高速度撮影でとらえた直径数ミクロンの微小気泡のふるまい.時間を200万倍に引き延ばして観察することにより,超音波照射下での微小な気泡のふるまいがはじめて解明されました.
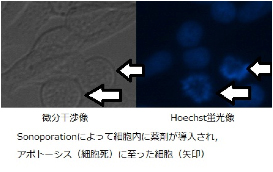 細胞のそばに気泡が存在する状態で超音波を照射すると,細胞膜の透過性が一時的に向上し,通常は入らない薬や遺伝子を細胞内に導入することができます.この現象をソノポレーションと呼び,抗がん剤のドラッグデリバリシステム(薬を必要な組織にのみ作用させる技術)や,細胞への遺伝子導入への応用が期待されています.
細胞のそばに気泡が存在する状態で超音波を照射すると,細胞膜の透過性が一時的に向上し,通常は入らない薬や遺伝子を細胞内に導入することができます.この現象をソノポレーションと呼び,抗がん剤のドラッグデリバリシステム(薬を必要な組織にのみ作用させる技術)や,細胞への遺伝子導入への応用が期待されています.
ソノポレーションによってがん細胞に抗がん剤が取り込まれ,アポトーシス(細胞の自殺)によりがん細胞が消えていく様子がとらえられています.
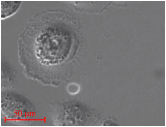 微小気泡による細胞治療の基礎研究には,微小気泡の位置を任意に制御できると便利です.しかし,血球よりも小さい気泡を自由に動かすことは困難です.我々はこれを実現するために光ピンセットを利用し,ホログラムで様々形状の光ビームを作成して,気泡の移動を実現しています.
微小気泡による細胞治療の基礎研究には,微小気泡の位置を任意に制御できると便利です.しかし,血球よりも小さい気泡を自由に動かすことは困難です.我々はこれを実現するために光ピンセットを利用し,ホログラムで様々形状の光ビームを作成して,気泡の移動を実現しています.
細胞の下に,ホログラム技術で作成したドーナツ状の光ビームが見えます.ドーナツの中に微小気泡を捕捉します.気泡を治療したい細胞の近傍に移動して超音波を照射すると細胞治療が実現できます.
 微小気泡に薬剤や遺伝子を付着させることにより,細胞内に効率よく薬剤を導入することができます.現在のがんに対する化学療法は,がんの組織だけではなく,正常な組織にも作用し,患者さんに大きな負担となります.がん組織に集まり,抗がん剤を閉じ込めた気泡ができれば,がん組織のみの化学治療が実現できます.
微小気泡に薬剤や遺伝子を付着させることにより,細胞内に効率よく薬剤を導入することができます.現在のがんに対する化学療法は,がんの組織だけではなく,正常な組織にも作用し,患者さんに大きな負担となります.がん組織に集まり,抗がん剤を閉じ込めた気泡ができれば,がん組織のみの化学治療が実現できます.
微小気泡の光学顕微鏡写真.2枚の写真は同じ気泡を撮影したもので,左の写真にある中心が明るい黒い粒が気泡です.右の写真では気泡の周囲に抗がん剤の成分を表す赤い蛍光が観察されています.
現在我々は,培養細胞を対象にソノポレーション現象の解明を行っています.しかし,最終的な目的は,もちろん生体内でソノポレーションを実現することです.そのためには,シャーレの中で培養された細胞と生体内の細胞で,ソノポレーション効果がどう異なるかを調べる必要があります.これを検討するため,生体を模擬した柔らかいゲル上に細胞を培養し,ソノポレーション効果がどう異なるかを調べています.
 微小気泡は,生体に大きな悪影響を与えませんが,超音波を照射すると期外収縮の発生頻度が増加することが報告されています.微小気泡をより安全な条件で利用するため,ラット新生仔から単離培養した心筋細胞を用いて,微小気泡が期外収縮を発生させるメカニズムを調べています.
微小気泡は,生体に大きな悪影響を与えませんが,超音波を照射すると期外収縮の発生頻度が増加することが報告されています.微小気泡をより安全な条件で利用するため,ラット新生仔から単離培養した心筋細胞を用いて,微小気泡が期外収縮を発生させるメカニズムを調べています.
ラット新生仔から単離培養した心筋細胞を用いると,自律拍動する培養細胞を作ることができます.期外収縮の発生を直接観察できる重要な観察です.
 超音波は,医療の現場で診断と治療の両面で広く利用されています.これらの装置の開発には,装置が発生する超音波を正確に評価する必要があります.我々は,光学的な技術を用いて,超音波の音場(音の広がり)を可視化する手法を新たに開発し,その有用性を検証しています.
超音波は,医療の現場で診断と治療の両面で広く利用されています.これらの装置の開発には,装置が発生する超音波を正確に評価する必要があります.我々は,光学的な技術を用いて,超音波の音場(音の広がり)を可視化する手法を新たに開発し,その有用性を検証しています.
水中を伝搬する超音波を可視化した結果.音圧が高い部分が白く,負圧の部分が黒く表示されています.目では見えない超音波が下から上に伝搬していく様子が可視化されています.