ゲノム情報から生物進化の過程に迫る

情報科学研究科 生命人間情報科学専攻
バイオインフォマティクス講座
情報生物学研究室・准教授
博士(理学)長田 直樹
プロフィール
1997年03月東京大学理学部生物学科卒、2002年03月同大学院理学系研究科生物科学専攻博士課程修了。米シカゴ大学進化生態学分野(リサーチアソシエイト)、国立感染症研究所(研究官)、独立行政法人医薬基盤研究所(研究員)、国立遺伝学研究所・総合研究大学院大学(助教)などを経て、2015年より北海道大学大学院情報科学研究科生命人間情報科学専攻准教授に就任。専門は集団遺伝学、分子進化学、バイオインフォマティクス。日本人類学会、日本分子生物学会、日本霊長類学会、日本進化学会、日本遺伝学、国際分子進化学会会所属。
集団遺伝学をDNAレベルで検証・解析
先生は今年(2015年)4月に情報科学研究科に着任されましたが、これまでの経歴や主な研究テーマを教えてください。
長田 もともとの専門は人類学です。東京大学大学院でヒト染色体の研究をしていたのですが、2000年にヒトゲノムの全塩基配列が解読され、ゲノム研究が大きな転換期を迎えました。そこで、私も研究テーマをゲノム情報を使ったヒトの進化にシフトさせ、「集団遺伝学」や「分子進化学」をベースとした研究に取り組んでいます。
集団遺伝学は、本来は生物の進化を解明するための学問でしたが、現在は医学や生物多様性保護など様々な分野に応用されている学問です。2010年から5年間所属した国立遺伝学研究所は、著名な集団遺伝学者である木村資生先生や、2015年にクラフォード賞を受賞した太田朋子先生などが所属する日本における遺伝学の総本山のような機関で、私もそこで木村先生の「中立説」や太田先生の「ほぼ中立説」(解説1)について深く学ぶことができました。
特に注目しているのが、同じ集団の中での生物の個体差です。ヒトのゲノムは約30億の塩基対からなっていますが、そのうちの0.1%程度が個体ごとに(父方由来、母方由来の染色体の間で)異なっています。その差がどのように形作られたのか、結果的にどのような変化を集団にもたらすのかを研究しています。
また、先に述べたように、個体差を扱う研究は医学の発展にも貢献しています。個々の遺伝子の違いによって病気のリスクや薬の副作用の出方が異なったりする場合があるからです。ですから私の研究室では進化のメカニズムを解明すると同時に、ヒトの疾患に関する研究も行っています。
2015年4月から本研究科の情報生物学研究室の教員となりました。生命人間情報専攻は生物と情報科学の融合した領域を研究するところで、ゲノム情報の多様性などを調べるには情報科学的な手法は重要です。バイオインフォマティクスの分野も本来は進化の考え方を基盤にして発展してきたものであり、そういう点でも非常につながりの深い分野だと思っています。
遺伝学と情報科学の融合とはどのようなものですか。
長田 従来の遺伝学は理論をベースに発展してきたものですが、それを検証するデータが十分ではありませんでした。2000年にヒトゲノムが解読され、さらに10年ほど前に登場した次世代シークエンサーによりDNA情報が短時間で大量に入手できるようになり、それらのデータを使って理論や仮説の証明が可能になってきたのです(長田准教授はゲノムデータや遺伝子の発現データを用いた研究において、2014年度日本遺伝学会奨励賞を受賞しました)。
遺伝子発現パターンの機構を解明するショウジョウバエの実験
現在取り組んでいる研究はどのようなものですか。

長田 まずひとつは遺伝子の発現パターンに関する研究です。例えば、ヒトとチンパンジーとではDNAレベルの違いは1%程度しかありません。それなのに見た目や知能がこれほど異なっているのはなぜか? この問題に対して1970年代から提唱されてきたのが、遺伝子の配列そのものではなくタンパク質が作られる量などの「発現」の仕方が違うという説です。遺伝子は臓器や血液などの身体を構成するタンパク質をコードしますが、その発現パターンの違いがヒトとチンパンジーでは大きな差があるとされているのです。
それを実証するために、ショウジョウバエを使った研究を行っています(解説2)。遺伝子は、遺伝子発現の調節領域に変異があると、発現調節の下流にある遺伝子の発現量が変化したり、2つ以上の変異が表現型に影響を及ぼす相互作用(Epistasis:エピスタシス)を起こしたりします。そのメカニズムは非常に複雑で、関連している遺伝子同士を抽出し、どのような関係性を持っているかを特定するのが難しいのです。そこで、本研究ではゲノム配列が分かっているさまざまな系統のショウジョウバエを掛け合わせ、次世代シークエンサーから得られた遺伝子発現データを解析することで、ゲノムの変異が遺伝子の発現にどのような変化をもたらしているかを明らかにしようとしています。
創薬開発にも貢献する霊長類ゲノムプロジェクト
他にはどのような研究が行われていますか。

長田 他にあげられるのは霊長類のゲノムプロジェクトです。霊長類には私たちヒトに近い類人猿(チンパンジー、ゴリラ、オランウータン、テナガザル)と、もう少し系統関係が遠い旧世界ザル(主にアジア・アフリカ大陸に生息)、新世界ザル(主に中央・南アメリカ大陸に生息)などに分かれます。本研究では、旧世界ザルであるアカゲザル、カニクイザル、アフリカミドリザルなどのゲノム配列解読(解説3)に取り組んでいます。
これらのサルは遺伝的多様性が大きく、同じ島に生息する同じ種のサルでもDNAレベルで0.3〜0.4%ほどの個体差があります。このようなサルとヒトとの遺伝的多様性の違いを説明するのには、前述の太田先生のほぼ中立説が非常に有効で、進化の過程でゲノムの違いがどのように起こり、どのように種の中に広まっていったかを解明する手がかりとなっています。
旧世界ザルは前臨床試験の対象として、医薬品の研究開発にも利用されているのですが、サルの産地によって治験の結果に違いが出ることがあります。こうした違いもゲノムを解析することでメカニズムを解明し、副作用や効果のより良い予測につなげることができるのではないかと考えています。
今後、ゲノムの解読によりどのようなことが解明できるのでしょうか。
長田 進化というと、数百万年から数億年前という過去の出来事のように思えますが、現在の生物の形態や生態は過去の歴史の結果として存在しています。また、現存する集団の遺伝的多様性は、今まさに起こっている進化の過程を反映しているともいえます.遺伝のメカニズムには分からないことがまだたくさんありますが、それが進化の歴史の結果であることは確かです。ゲノムを解読することでその歴史を明らかにし、それが起こった原因を推定することは、この研究の目的のひとつでもあります。
近い将来、さらに発展した第3世代シークエンサーが登場し、ヒトやサルだけでなくさまざまな野生生物のゲノムが特定されると予想されています。動物や植物の遺伝子型と生態との関わりが解明されれば、進化の謎に迫ることができるのではないかと思います。また、ビッグデータの解析が現在盛んに行われていることに象徴されるように、将来的には、大規模なゲノムデータや環境データから生物の表現型を予測し、その情報を用いた研究が可能になるのではないかと考えています。北海道大学は生態学の研究も盛んですので、それらの研究者と協力しながら、謎の解明に取り組んでいきたいですね。
解説
解説1:「ほぼ中立説」
国立遺伝学研究所の木村資生博士(1924〜1994)は、1960〜1970年代にかけて「分子レベルでの遺伝子の変化は大部分が自然淘汰に対して有利でも不利でもなく(中立的)、突然変異と遺伝的浮動が進化の主因である」とする「中立説」を提唱した。これに対し、太田朋子博士による「ほぼ中立説」では「自然選択の有効性は集団の大きさに影響を受ける」と予測し、非常に弱い効果であるが生物の適応度を下げるような変異(弱有害変異)は、小さい集団では偶然の効果(遺伝的浮動)により集団中に広まることができるが、大きな集団では広まることができないとした。
解説2:キイロショウジョウバエにおける集団内でのcisおよびtrans遺伝子発現変異の定量
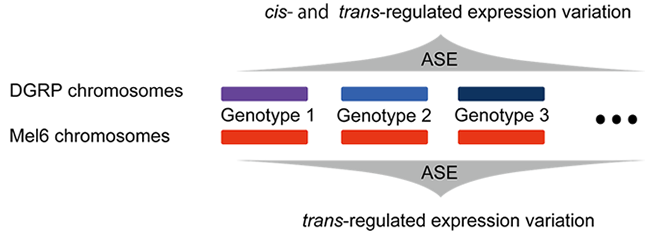
異なった遺伝子型を持つショウジョウバエを掛け合わせて、遺伝子発現を次世代シークエンサーによって定量する。遺伝子発現の変化の原因となる遺伝的変異は、プロモータ配列の変異の様に直接の効果を持つcis制御変異と、転写因子の作用のように間接的な効果を持つtrans制御変異とに分けることができる。アリル間の遺伝子発現比(ASE)の分散を測定することにより、どれだけの遺伝子発現変異がどのように遺伝的変異によってコントロールされているかを推定できる(首都大学東京進化遺伝学研究室との共同研究)。
解説3:アフリカミドリザル腎由来Vero細胞のゲノム配列決定
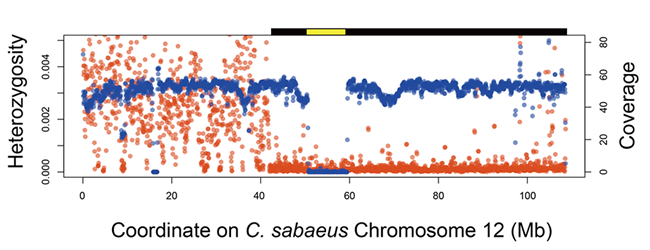
Vero細胞はアフリカミドリザル(Chlorocebus sabaeus)腎臓由来の細胞で、世界中で幅広くワクチン産生や細胞毒性の評価などに用いられている。Vero細胞ゲノム解析の結果、免疫や細胞分裂に関わる遺伝子を多く含む染色体上の領域で、9Mbpにわたる欠失とそれを含むさらに大きい領域でのヘテロ接合の喪失(LOH)が観察された。この欠失がVero細胞でのウィルス増殖能力に関わっていると考えられる。横軸は染色体上の位置、縦軸は赤い丸がヘテロ接合度(左のラベル)、青い丸がゲノムのリードカバー率(右のラベル)を示す。9Mbpの欠失を黄色、LOH領域を黒のバーで表す。
図はOsada
et al., 2014, DNA
Researchより引用(国立感染症研究所、国立研究開発法人医薬基盤・健康・栄養研究所との共同研究)。
http://dnaresearch.oxfordjournals.org/content/21/6/673.abstract
