化学と量子科学をベースとした核偏極MRI技術を開発
疾患メカニズムの解明や画像診断の最先端を切り拓く

情報科学研究院
生命人間情報科学部門
バイオエンジニアリング分野 磁気共鳴工学研究室・准教授
博士(薬学)松元 慎吾
プロフィール
2000年3月、九州大学薬学部卒業(機能分子解析学 研究室)。2002年3月、九州大学薬学研究院修士課程修了、2005年3月、同 博士後期課程修了(薬学博士)。2005年12月〜2014年6月、米国立がん研究所(NCI/NIH)でPostdoctoral Fellow(放射線生物学部門、Dr. Krishna M.C. Lab.)、Research Fellow(放射線生物学部門、Dr. Krishna M.C. Lab.)、Staff Scientist(放射線生物学部門、Dr. Krishna M.C. Lab.)として従事。 2015年2月より北海道大学 大学院情報科学研究院・准教授。
医療分野で期待が高まる核偏極MRI最先端技術の研究
磁気共鳴工学研究室ではどのような研究を行っているのですか。
松元 私たちの研究室では、生物医学分野への応用を目指して新しい電子常磁性共鳴および核磁気共鳴イメージング法を開発しています。具体的には、病院などで検査を受けるときによく使われるMRIの最先端技術の開発です。核磁気共鳴画像(Magnetic Resonance Imaging:MRI)による形態像はがんなどの疾患の正確な診断や治療効果の評価に不可欠な技術です。しかし、核磁気共鳴はその本質的な検出感度の低さから分子レベルのイメージングへの応用は限られています。
一方、CTやPET(positron emission tomography :陽電子放出断層撮影)という画像診断技術もありますが、CTは放射線(X線)を使って画像を得る技術ですし、PETは放射性薬剤を体内に投与するなど、わずかではありますが被ばくします。こうした状況から、放射線被ばくがなく、しかも高感度で分子レベルのイメージングができるMRIの開発が求められてきました。
当研究室で取り組んでいるのは、分子内の特定の核スピンに熱平衡状態の数万倍に及ぶ「超偏極」を誘導する技術を用いた分子イメージング技術です。この手法の特徴は、がんなどの疾患部位の形態ではなく、分子の代謝の違いを観測して生体の微小環境を見極めることです。
代謝の状態を測るための標識として主に使われているのが炭素13核(13C)です。13C核スピンは通常のMRIでは検出されませんが、超偏極により数万倍に感度を増幅することで検出が可能になります。例えば、核偏極13C MRIでがんの検査を行う場合は、グルコースの主要な代謝中間体であるピルビン酸を13Cで標識し、超偏極させたものを代謝プローブとして人体に投与し、MRIで検出することにより正常な細胞とがん細胞での代謝の違いを可視化します。(解説1)
ピルビン酸はもともと体内に多く存在する物質であり、PETのように放射性物質も使用しないので、より安全な検査方法といえます。また、一人の患者さんに短期間に何回も使用できるので、腫瘍の有無や悪性度を確認するだけでなく、抗がん剤などの治療効果を測ることもでき、より良い治療法をいち早く見つけることができると期待されています。
化学反応によって核スピン偏極を可能にするパラ水素誘起偏極法
炭素13核スピンの超偏極はどのように行われるのですか。

松元 13Cに超偏極を誘導する主な手法には(1)動的核偏極法(DNP)、(2)パラ水素誘起偏極(PHIP)法があります。動的核偏極法とは、電子スピンと核スピンの二重共鳴に基づく超偏極の誘導法で、高磁場と超低温下で13C核スピンが超偏極した代謝プローブを得ることができます。
DNPはすでに欧米では実用化され、臨床研究も進められています。ヒトの膵管がんをモデルとした実験では、がんの種類や特性によって抗がん剤や放射線治療の効果に違いが出ることを確認できる結果が得られています(解説2)。
しかし、DNPの装置は導入に数億円かかり、また1回分の代謝プローブを製造するのに3〜4時間必要なため、一般の病院に普及させるのは難しく、アメリカでも十数カ所の医療機関で臨床研究が行われている程度です。
そこで、より安価に超偏極誘導する方法として登場したのが「パラ水素誘起偏極法」です(解説3)。これは、水素分子の付加反応を用い化学的に核スピン偏極を誘導する方法です。高磁場も超低温も必要なく、臨床用装置も数千万円程度で導入できると考えられるので、実用性の高い技術として期待されています。
パラ水素誘起偏極法そのものは1980年代にすでに発見されていたのですが、ピルビン酸を励起することができなかったため、超偏極13C MRIへの応用性は低いと考えられていました。ところが、2015年にイタリアの研究チームがピルビン酸を励起する方法を開発し、一気にパラ水素誘起偏極法による超偏極13C MRIの研究開発が加速しました。現在は世界各国で開発競争が展開されている注目度の高い研究領域です。
私たちの研究グループは、パラ水素誘起偏極法を用いた代謝プローブ生成技術の開発と実用化の研究に取り組んでいます。最新の研究では、パラ水素由来の2つの超偏極1Hから13Cヘの量子状態の遷移が2段階の分極移動で起きることを見出し、この新たな分極移動機序を励起に実装することで、13C偏極率(MRI感度に比例)を従来条件より2倍以上改善することに成功しました。(解説4)
核偏極MRIの普及を目指した代謝プローブ生成技術の実用化を目指して
今後はどのように研究を進めていく計画ですか。

松元 実用化へ向けた装置の開発に力を入れているところです。パラ水素誘起偏極法による代謝プローブの製造プロセスには5段階ぐらいあるのですが、溶液を混ぜたり、余計な物質を除去したりする作業は人の手でやっています。化学を専門としている人にとってはそれほど難しい作業ではないのですが、医療現場で使うにはそれを完全に自動化し、ボタンひとつで励起された溶液を生成できる装置を開発しなければなりません。手作業でできるからといって簡単に機械化できるわけではないので、均質な製品を安定的に供給できるよう、シミュレーションや実験を繰り返しながら精度を上げていく必要があります。
核偏極MRIの研究には、疾患の解明や診断に有用な分子を設計し有機合成するために必要な生物学や化学、量子力学計算に基付き分子内の特定の核スピンに超偏極を誘導する技術を開発する数学や物理学、MRI装置を開発する電気電子工学、AI技術を用いた画像再構成との組み合わせにより高速撮像を実現する情報科学など、様々な知識が不可欠です。当研究室にもさまざまな分野の専門家が在籍し、さらに学外の研究機関とも協働する場面がたくさんあります。私自身も薬学が専門ですが、薬学の中でも物理系・工学系の分野で各種装置の開発になど多分野にまたがる研究に携わってきました。多様な分野の研究者が集う超偏極MRIの開発は、医療分野に貢献できるのはもちろん、革新的な研究分野の開拓にもつながるのではないかと思っています。
解説
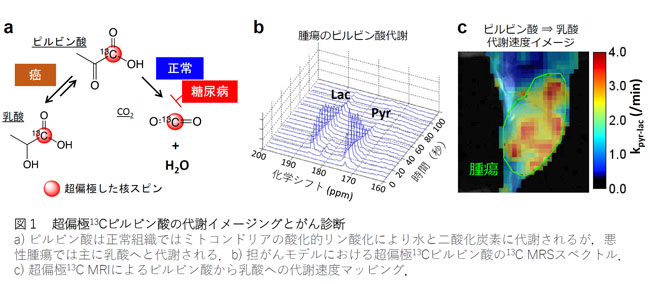
解説1:超偏極13C MRIによる代謝イメージング
ピルビン酸は正常組織では主にミトコンドリアの酸化的リン酸化により水と二酸化炭素へと代謝されるが、癌組織ではピルビン酸脱水素酵素の抑制と乳酸脱水素酵素の活性化により乳酸への代謝フラックスが亢進する。この代謝変容をマーカーとした、酵素活性イメージングによる癌の画像診断が実用化されつつある。
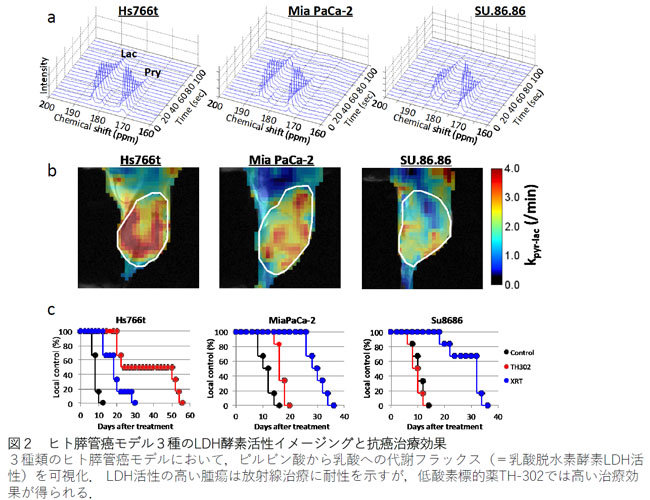
解説2:ヒト膵管癌モデル3種のLDH酵素活性イメージングと抗癌治療効果
3種類のヒト膵管癌モデルにおいてピルビン酸から乳酸への代謝フラックス(=乳酸脱水素酵素LDH活性)を可視化。LDH活性の高い腫瘍は放射線治療に耐性を示すが、低酸素標的薬TH-302では高い治療効果が得られる。
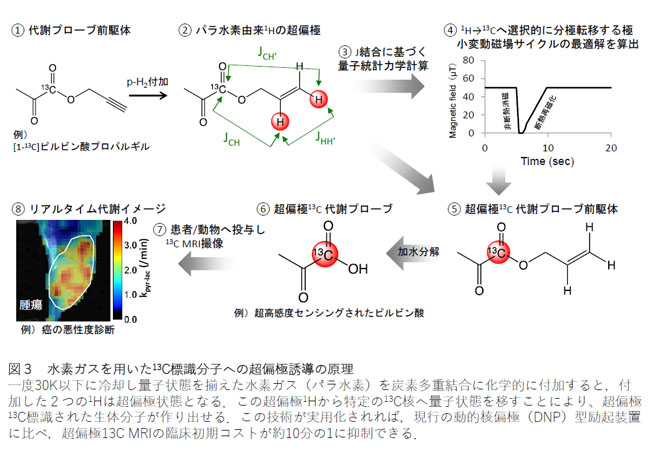
解説3:水素ガスを用いた13C標識分子への超偏極誘導の原理
量子状態を揃えた水素ガスであるパラ水素を、カルボン酸を有する酵素基質の不飽和エステル前駆体に付加することで、2つの超偏極1H を生成する。1H から13C へと分極移動した後にエステル側鎖を加水分解することで、超偏極13Cを持つ代謝プローブを作成する。
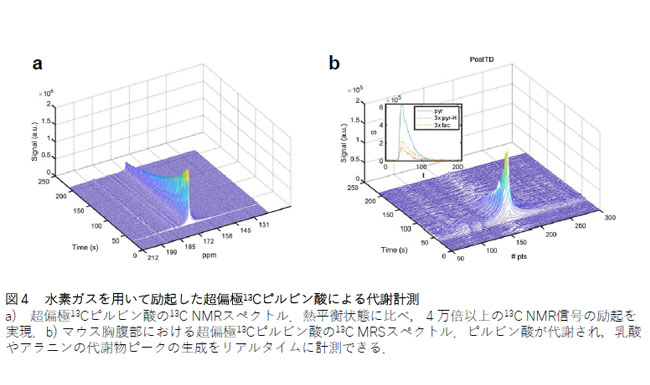
解説4:水素ガスを用いて励起した超偏極13Cピルビン酸による代謝計測
a)は超偏極13Cピルビン酸の13C NMRスペクトル。熱平衡状態に比べ4万倍以上の13C NMR信号の励起を実現した。b)はマウス胸腹部における超偏極13Cピルビン酸の13C MRSスペクトル。ピルビン酸が代謝され、乳酸やアラニンの代謝物ピークの生成をリアルタイムに計測できる。